海外では使われている有効な薬が、なぜ日本では使えないのか――医師であれば、こうした疑問を抱いたことのある人も少なくないでしょう。薬の承認をめぐって近年注目されているのが、「ドラッグ・ロス」と呼ばれる概念です。似た言葉に「ドラッグ・ラグ」がありますが、この2つは異なる課題を指しています。
この記事では、ドラッグ・ロスとドラッグ・ラグの違い、ドラッグ・ロスが発生する背景、対策などを見ていきます。ドラッグ・ロスについて幅広くお伝えしますので、ぜひ最後までご覧ください。

執筆者:Dr.SoS
ドラッグ・ロスとは
「ドラッグ・ロス」とは、海外ですでに承認・使用されている有効な医薬品が、日本国内ではそもそも開発(承認申請)にすら至っていない状態を指します。
たとえば「海外では標準治療として使われているのに、日本では選択肢に含めることができない薬剤」が該当します。
希少疾患やがん領域を中心に、現場の医師や患者さんにとって"使いたくても使えない薬"が増えているのが現状です(ここで言う「海外」とは、主にアメリカ(FDA:米国食品医薬品局)やヨーロッパ(EMA:欧州医薬品庁)を想定しています)。
当該薬剤を使えないことは、患者さんにとって「選択肢が存在しない」という重大な不利益になる可能性があり、医療者側にとっても治療計画の立案や説明に大きな制約をもたらします。
背景には、市場規模や開発コストの問題、薬価制度の不確実性などが複合的に影響しています。
医師としては、使えない・手に入らない薬によって患者さんの予後や治療選択にどのように影響するかを理解し、適切に代替策を講じる必要があります。
ドラッグ・ロスの現状
ドラッグ・ロスが具体的にどの薬剤や領域に生じているのか、厚生労働省「ドラッグ・ロスの実態調査と解決手段の構築」研究班から公表されている86品目のリストを見るとわかります。
このうち8品目は2025年3月末時点でドラッグ・ロスが解消されており、現在は事実上78品目が該当します*1。これらは開発の必要性に応じて、4つのグループに分類されています。
| グループA「開発の必要性が特に高い医薬品」 | 14品目 |
|---|---|
| グループB「開発の必要性が高い医薬品」 | 41品目 |
| グループC「開発の必要性が低い医薬品」 | 11品目 |
| グループD「開発の必要性がない医薬品」 | 12品目 |
https://www.mhlw.go.jp/content/10808000/001462594.pdf(2025年9月10日閲覧)
薬効別に見ると、抗悪性腫瘍薬・全身性抗感染症薬・神経系用剤が多くを占めているという報告があります(2020年末現在)*2。
ほかに特性として、ベンチャー企業発の医薬品・希少疾病用医薬品(オーファンドラッグ)・小児用医薬品が、それぞれ56%・47%・37%と、比較的高い比率を占めることもわかっています(いずれにも該当しない薬剤は16%)*1。
これは、以下の要因が重なった結果であると考えられます。
①日本国内の患者数が少なく、投資回収が見込みにくい
②治験を実施するためのインフラ整備が遅れている
③薬価の見通しが不透明である など
こうしたギャップを解消しようと、政府や厚生労働省は「先駆的医薬品指定制度」や「条件付き早期承認制度」といった制度を整備しつつあります。近年は、2023年の骨太の方針(「経済財政運営と改革の基本方針2023」)でドラッグ・ロスの問題が扱われ、翌年度の薬価改定方針にも生かされました(後述)。しかし政策が機能し多様な医薬品がタイムリーに患者さんへ届くまでには、一定の時間を要することが見込まれます。
ドラッグ・ラグとの違い

ドラッグ・ロスと類似するキーワードとして「ドラッグ・ラグ」があります。ドラッグ・ラグとは、海外で承認・販売されている医薬品が日本で承認・使用できるようになるまでに「時間差」(=ラグ)がある状態を示す言葉です。
ドラッグ・ラグは、2000年代初頭から社会問題として注目されました。医薬産業政策研究所の調査では、2000~2006年に国内で承認された新薬のうち、54品目には約4年のドラッグ・ラグがあったと述べています*3。
しかし、医薬品医療機器総合機構(PMDA)による審査期間の短縮や、治験環境の整備による国際共同治験の推進、薬価制度のインセンティブなどの施策により、ドラッグ・ラグは近年、解消へと向かっています。完全にゼロにはなっていませんが、2013~2016年の中央値は30カ月以上、2022年は16.4カ月と*4、着実に減ってきています。
ドラッグ・ラグとドラッグ・ロスは、どちらも「海外では使えるのに、日本では使えない状態」という共通点があるため、表面的には同じ意味のように見えることがあります。しかし実際には、以下のような違いがあります。
- ドラッグ・ラグは、時間経過とともに解消される可能性がある
- ドラッグ・ロスは、解消される見込みが不透明である(時間経過で改善する可能性が低い)
【ドラッグ・ラグとドラッグ・ロスの比較】
| ドラッグ・ラグ | ドラッグ・ロス | |
|---|---|---|
| 開発・承認状況 | 申請はされているが日本での承認・上市が遅れている | そもそも日本で開発・申請が行われていない |
| 臨床への影響 | 治療選択肢として"遅れて到来する" | 治療選択肢として"存在しない" |
| 主な原因 | 審査期間の長さや不透明さ、治験環境の未整備 | 市場規模や投資対象としての魅力・ 新興企業の数が少ない |
| 品目数(2023年3月時点)*1 | 57 | 86(※) |
(※)2025年3月末時点では78品目*1。
こうした違いから、ドラッグ・ラグとドラッグ・ロスには医療政策上はもちろん、現場の医師一人ひとりの判断においても異なるアプローチが必要となります。
ドラッグ・ロスが生じる原因と背景
ここからは、ドラッグ・ロスが生じる原因や背景を、もう少し深く見ていきましょう。要因はさまざまあるとされていますが、ここでは下記3つを取り上げます。
- 新薬開発における新興企業の台頭
- 治験や薬価制度にかかわる問題
- 日本企業の国際競争力の低下
新薬開発における新興企業の台頭

ドラッグ・ロスに陥っている薬剤は、海外で新興企業(ベンチャー企業)が開発を担っているケースが多くみられます。
かつては、新薬の開発は大手企業が担い、国際共同治験などを実施する流れが一般的でした。しかし近年は小規模なバイオベンチャー企業が中心となって開発に取り組み、最終的に大手企業に買収(M&A)される形が増えています*5。
実際、2015~2021年にアメリカで承認された医薬品の約65%は、小規模なバイオベンチャー企業が開発しているという報告があります*6。
このようなベンチャー企業は欧米に本社を置く場合が多く、大手企業と異なり資金的に複数市場への同時展開が難しいため、日本市場が後回しになってしまう傾向があると言えます。その結果、ドラッグ・ロスにつながる可能性があるというわけです。
治験や薬価制度に関する問題
治験や薬価に関する制度設計も、ドラッグ・ロスの要因となっています。
新薬がドラッグ・ロスを起こさず日本で承認されるには、海外で承認される際に実施される国際共同治験の対象地域に含まれる必要があります。しかし、薬事承認申請に重要な「ピボタル試験」に日本が含まれる割合(組入れ率)が、新興企業でとくに低いことが指摘されています。
ピボタル試験への組入れの有無はドラッグ・ラグの期間にも大きく影響するなど、ドラッグ・ラグとドラッグ・ロス双方にかかわる問題と言えます。
組入れ率が低い原因は十分に解明されてはいませんが、日本語書類の整備や費用の面など、試験開始のハードルの高さが考えられています。
薬価については「医療費削減」という国の方針もあり、診療報酬改定でもマイナス改定が続いています。これもまたドラッグ・ロスの要因と考えられます。
新薬開発には長い期間と多額の費用が必要ですが、日本の低い薬価では値下げが繰り返される場合があります。例として、世界で初めて免疫チェックポイント阻害薬として承認されたニボルマブ(オプジーボ®)100 mgの薬価は、発売時(2014年9月)は72.9万円でしたが*7、2025年現在は13.2万円と*8、82%値下がりしています。
薬価の引き下げで薬剤を使用できる患者さんが増えるという利点はあるにせよ、開発を担う製薬企業にとっては長期の収益予想を立てることが難しくなってしまいます。日本市場が魅力的に映らないのも、やむを得ないのかもしれません。
日本企業の国際競争力の低下
新薬開発の主軸がベンチャー企業になっていると述べましたが、残念ながら日本ではベンチャー企業による創薬があまり進んでいません。
原因として、日本では開発対象の移行(従来の低分子医薬品からバイオ医薬品へ)の遅れが指摘されています。世界の医薬品売上高(2022年)の上位100品目のうちバイオ品目は45品目を占めていますが、そのうちアメリカ企業による開発が19品目ある一方で、日本企業は2品目にとどまっています*5。
日本発の企業であれば、早期から日本での承認取得を目指すことが想定されますから、これもまたドラッグ・ロスの原因の一つと考えられます。
ドラッグ・ロスが臨床に与える影響
ここからはドラッグ・ロスの影響について、臨床医の立場から考えてみたいと思います。
治療方針の制約
ドラッグ・ロスによって、医師が医学的に最良と判断する治療薬が日本で使えないケースが生じ得ます。単なる利便性にとどまらず、診療の質や治療成績、場合によっては患者さんの生命予後にも直接影響を与え得る問題です。
たとえば、筆者が専門とする皮膚科領域では、ざ瘡(ニキビ)治療薬のトリファロテンやクラスコステロンなど、日本で未承認の外用薬が存在します(本稿執筆現在)。
先述した厚生労働省のリストにおいて、トリファロテンはグループA(開発の必要性が特に高い医薬品)、クラスコステロンはグループD[開発の必要性がない医薬品(=すでにドラッグ・ロスが解消されている医薬品)]に分類されています。つまり、両者はそれぞれドラッグ・ロス、ドラッグ・ラグの状態にあります。
トリファロテンは第4世代レチノイド外用薬に分類される薬剤で、海外では顔面に加えて体幹のざ瘡についても保険適用となっています。一方、日本で唯一保険承認されているレチノイド系外用薬アダパレンは、顔面のざ瘡にしか保険適用がありません。
クラスコステロンはアンドロゲン受容体阻害効果を持つ外用薬であり、これまでの既存薬とは機序が異なるため、既存治療で効果不十分な患者さんにも効果が期待できる薬剤です。
トリファロテンやクラスコステロンが使えない日本のざ瘡治療は、従来のレチノイド製剤や抗菌薬の長期使用に頼らざるを得ません。これにより耐性菌や副作用リスクの増大が懸念されるほか、十分な治療効果を得られない重症例もみられます。
一般名「アダパレン」添付文書等一覧|医薬品医療機器総合機構(PMDA)
Adelaide Hebert,et al.:Efficacy and Safety of Topical Clascoterone Cream, 1%, for Treatment in Patients With Facial Acne: Two Phase 3 Randomized Clinical Trials.JAMA Dermatol 156(6): 621-630,2020
▼関連記事はこちら
「耐性菌」とは?薬剤耐性(AMR)の原因や対策など基本事項を解説【医師向け】
エビデンスの蓄積遅延
日本で正式な承認薬とならなければ、日本における臨床データが不足することにもなります。これにより、国内のガイドライン策定や学会の推奨にも時間差が生じます。
たとえば、先述したトリファロテンやクラスコステロンはいずれも米国皮膚科学会のガイドラインでは第一選択薬の一つと位置付けられていますが(本稿執筆現在)、日本皮膚科学会のガイドラインには(治療アルゴリズムやクリニカル・クエスチョンとして)掲載されていません。
国内で標準治療となるまでに時間がかかると、ドラッグ・ロスの解消後も薬剤の普及や標準化にさらに時間を要す可能性があります。ドラッグ・ロスは、医療現場全体の最適化が遅れることにもつながり得ると言えるでしょう。
Rachel V. Reynolds,et al.:Guidelines of care for the management of acne vulgaris.JAAD 90(5):1006.e1-e30,2024
尋常性痤瘡・酒皶治療ガイドライン策定委員会:尋常性痤瘡・酒皶治療ガイドライン 2023(日本皮膚科学会ガイドライン).日本皮膚科学会雑誌 133(3): 407-450,2023
ドラッグ・ロスへの主な対策と今後の展望
日本で未承認となっている薬剤を使えるようにするには、製薬企業の努力が欠かせません。しかし企業努力に期待するだけでは、ドラッグ・ロスの解消は難しいことも事実です。
ここからは、ドラッグ・ロスの解消に向けて取り組まれている対策や今後の展望を見ていきます。
ドラッグ・ロスに対する国の取り組み
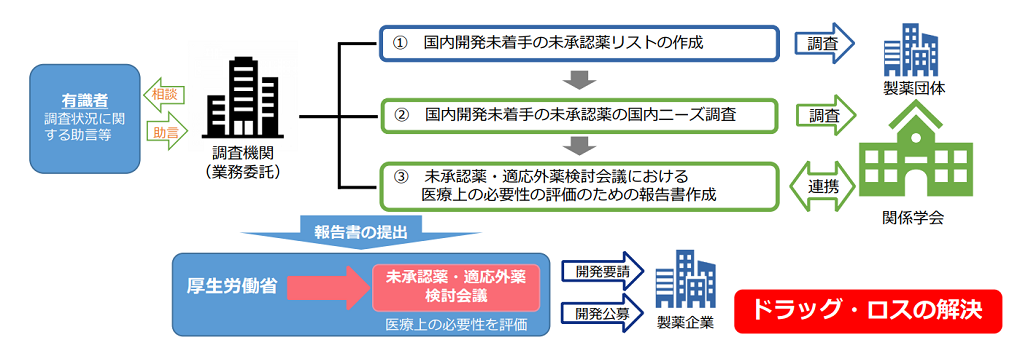
国はこれまで、実態を把握するための調査を実施してきました。結果は「ドラッグ・ロスの実態調査と解決手段の構築」研究の資料で公表され*1、とくに「医療上の必要性の高い未承認薬・適応外薬」については、製薬企業に対して開発要請を行うとされています。
ただ、そもそも収益面で魅力が乏しいことも、開発が進まない要因でしょう。この点に対しては、新薬に関する薬価制度の改定が実施されてきました。薬価検討の際には「有用性加算」として"加算率"が決められますが、2024年度はこの評価項目に、難病・希少疾病等に対する新薬であることが追加されました。また、希少疾病と同じくドラッグ・ロスの多い小児用医薬品に対しても、加算がされやすくなるような制度変更がありました。
売上が大きくなった医薬品の薬価が引き下げられる"共連れルール"は、先述したニボルマブの薬価が大きく下がった要因です。これも一部の医薬品は除外されることになりました。
また、2024(令和6)年には「未承認薬等迅速解消促進調査事業」が設立され、取り組みが進められています。未承認薬の評価に必要な情報を整理し、2026年度までに開発要請や公募に至ることが目指されています。
https://www.mhlw.go.jp/content/10808000/001462594.pdf(2025年9月10日閲覧)
政策研ニュース No.73「補正加算を中心とした新医薬品の算定状況の推移 -2024年度薬価制度改革後の収載3回分を含めた調査-」(2024年11月)|日本製薬工業協会 医薬産業政策研究所
厚生労働科学研究費補助金(厚生労働科学特別研究事業) 薬価算定基準における画期性及び有用性加算の加算率の定量的算出法に係る研究|厚生労働省 第101回中央社会保険医療協議会薬価専門部会(2014年4月)
令和6年度薬価改定に係る薬価算定基準の見直しについて(案)|厚生労働省 第579回中央社会保険医療協議会総会(2024年1月)
令和6年度薬価制度改革の骨子(令和6年1月17日開催/中央社会保険医療協議会総会(第579回)資料 総-2 参考1より作成)(ジェネリック研究 18:051-061,2024 )|日本ジェネリック医薬品・バイオシミラー学会 ジェネリック医薬品の情報システム
薬価算定の基準について|厚生労働省 第579回中央社会保険医療協議会総会(2024年1月)
ドラッグ・ロスに対して医療現場で取り組めること
ドラッグ・ロスの解消は、医師や患者さんなど、医療現場の主体的な動きがあってこそ進展します。
とくに希少疾患は患者数が少ないため、患者さんの声がなかなか集まりにくいでしょう。しかし「海外で承認されている薬剤を日本でも使えるようにしてほしい」という署名活動や医療現場・患者会からの情報発信などが広がれば、世論が後押ししてくれる展開も考えられます。
医師側からは、海外の標準薬が使えないことで転帰に差が出ている症例など、"既存治療の限界"を具体的なデータとして学会・論文で発信することで、"医療上の必要性"を明確にすることにつながるでしょう。
まとめ
この記事ではドラッグ・ロスの定義やドラッグ・ラグとの違い、原因・背景や医療現場への影響、そして解消に向けた対策について見てきました。ドラッグ・ロスは海外で承認・使用されている有効薬が日本でそもそも開発・申請されない状況を指し、希少疾患やがん領域でとくに顕在化しています。国も問題と考えており、解決に向けた対策が進みつつありますが、まだ道半ばなのが現状です。
医師個人ができることは限られますが、有効な治療薬が利用できないことによる問題点を、学会などを通じて伝えていく、またどのような治療法があるのか海外論文や学会講演などから学ぶ姿勢は重要と言えるでしょう。
この記事がドラッグ・ロスを理解する一助となれば幸いです。
プレスリリース「令和6年度厚生労働科学特別研究事業「ドラッグ・ロスの実態調査と解決手段の構築」研究班の整理結果を公表します」(令和7年3月31日)|厚生労働省(*1)
ポジションペーパー No.2「ドラッグ・ラグ/ロスの実態把握と要因分析」(2024年5月24日版)|日本製薬工業協会 医薬産業政策研究所(*2)
政策研ニュース No.24「ドラッグ・ラグ短縮に向けて取り組むべき課題―製薬企業アンケートに基づく分析―」(2008年2月)|日本製薬工業協会 医薬産業政策研究所(*3)
政策研ニュース No.70「ドラッグ・ラグ:日本承認品のラグ実態の分析」(2023年11月)|日本製薬工業協会 医薬産業政策研究所(*4)
政策研ニュース No.66「ドラッグ・ラグ:なぜ、未承認薬が増えているのか?」(2022年7月)|日本製薬工業協会 医薬産業政策研究所
鈴木智之:ドラッグ・ロスの現状及び対策.国立国会図書館 調査及び立法考査局 レファレンス891:89-118,2025(*5)
Alexander Schuhmacher,et al.:Investigating the origins of recent pharmaceutical innovation.Nat Rev Drug Discov 22(10):781-782,2023(*6)
新医薬品の薬価算定について(一部抜粋)|厚生労働省 第281回中央社会保険医療協議会総会(2014年8月)(*7)
市場拡大再算定品目について≪薬価算定組織 第1回令和5年11月21日、第2回令和5年11月28日、第3回令和5年12月5日≫|厚生労働省(*8)
バイオベンチャーの支援|経済産業省
※URLは各サイトの利用規約等に従い、一部は許諾を得て掲載しています。