後発医薬品(ジェネリック医薬品)は、先発医薬品と同じ有効成分を含み、同様の効能・効果が期待できる医薬品です。研究開発にかかる費用が少ない分、薬価を抑えられるメリットがあり、日本では医療費削減政策の一環として普及が推進されてきました。
その一方で、とくに2020年代以降は品質や供給に関する課題も生じています。薬局から、処方した薬剤の在庫がないと連絡を受けたことのある先生も少なくないのではないでしょうか。
この記事では、医師が知っておきたい後発医薬品の基本的な情報から、2024年10月に始まった「長期収載品の選定療養」制度、昨今の使用割合や課題を解説します。

執筆者:Dr.SoS
後発医薬品とは
「後発医薬品」とは、先発医薬品(新薬)の特許が切れたあとに発売される医療用医薬品です。「ジェネリック医薬品」とも呼ばれ、原則として先発品と同じ有効成分や効能・効果を持ちます。
ヒトに投与するため安全性が十分配慮され、生物学的同等性試験(BE試験)や溶出試験を経て承認されます。
先発品と比べて開発期間やコストを抑えることができるため、薬価が新薬の5〜7割程度と、安く設定されています。
後発医薬品とバイオシミラーの違い
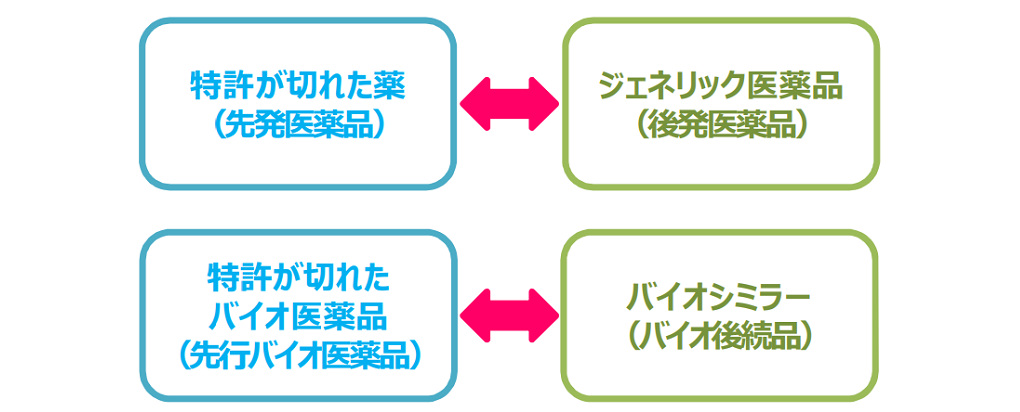
後発医薬品と類似する用語として、「バイオシミラー」(バイオ後続品)があります。
両者の違いは、後発医薬品が低分子化合物に対して用いられる名称であるのに対し、バイオシミラーは高分子化合物であることです。
たとえば、生物学的製剤(先行バイオ医薬品)であるインフリキシマブやリツキシマブは高分子化合物のため、その後発品はバイオシミラーであり、後発医薬品とは区別されます。
https://www.mhlw.go.jp/content/001380078.pdf(2025年6月16日閲覧)
高分子化合物は構造が複雑で、同一性を示すことが困難です。そのためバイオシミラーの臨床試験では、先発品(先行バイオ医薬品)との同等性・同質性を示せば良いことになっています。

https://www.mhlw.go.jp/content/001380077.pdf(2025年6月16日閲覧)
バイオ後続品(バイオシミラー)に関する基本的なこと~一般の皆様への広報資料~|厚生労働省
バイオ後続品(バイオシミラー)の使用促進について|厚生労働省
バイオ医薬品・バイオシミラー講習会|厚生労働省
バイオ医薬品・バイオ後続品に関連するホームページ|厚生労働省
日本で承認されているバイオシミラー一覧|日本バイオシミラー協議会
後発医薬品のメリットは「医療費削減」
後発医薬品を使用するメリットは、なんといっても「医療費の削減」です。開発期間やコストを抑えることができるため、薬剤によっても異なりますが、先発品と比べて5〜7割程度の薬価に設定することができます。
そのため患者さんの自己負担も軽減することができ、治療アドヒアランスの向上、大局的に見れば「国民医療費の抑制」につながります。
日本では、高齢化などに伴い医療費の増大が大きな課題となっています。2022年度の医療費は約46.7兆円で、20年前の31.0兆円、10年前の39.2兆円と比べて増加傾向にあります*1。
医療費を少しでも抑制するため、後発医薬品の普及は一つの解決策として、国をあげて推進されています。
後発医薬品の使用割合・普及状況
後発医薬品の概要を理解したところで、ここからは後発医薬品がどれくらい使用され、普及しているのかを見ていきましょう。
政府は2017年、後発医薬品の普及目標を以下のように定めています。
2020年(平成32年)9月までに、後発医薬品の使用割合を80%とし、できる限り早期に達成できるよう、更なる使用促進策を検討する。
https://www5.cao.go.jp/keizai-shimon/kaigi/cabinet/honebuto/2017/2017_basicpolicies_ja.pdf(2025年6月16日閲覧)
その2020年9月の実績(後発医薬品の普及率)は、78.3%でした*2。目標には少し届かなかったものの、2007年は34.9%だったことをふまえると*2、飛躍的にそのシェアを伸ばしたと言えるでしょう。
後発医薬品のある先発医薬品(長期収載品)の選定療養

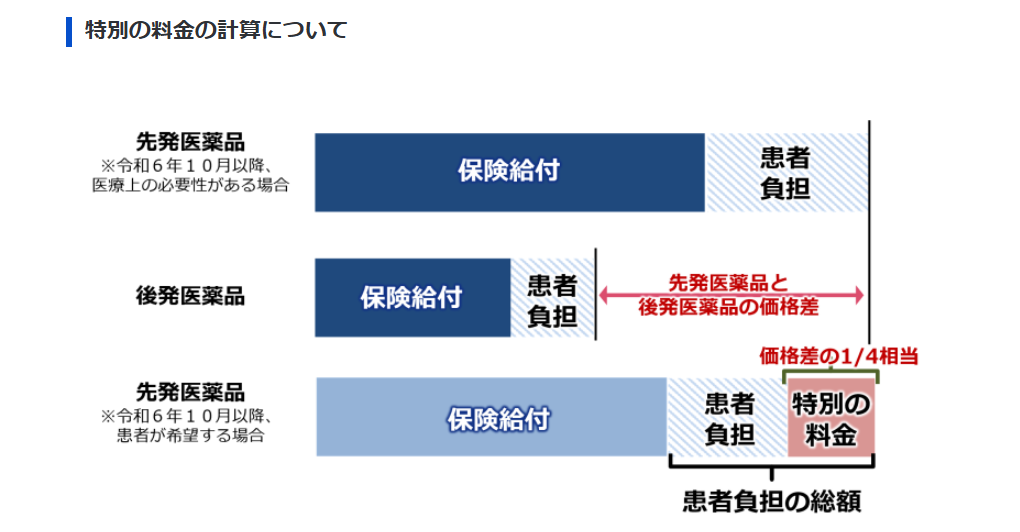
後発医薬品に関する最近のトピックとして、後発医薬品がある先発医薬品(長期収載品)の選定療養があります。後発医薬品の普及を促進するため、後発医薬品が存在するのに先発医薬品の処方を希望する場合の「患者負担」額が増える(「特別料金」が発生する)制度で、2024年10月から始まっています。
https://www.mhlw.go.jp/stf/newpage_39830.html(2025年6月16日閲覧)
制度の影響は大きく、保湿剤(ヒルドイド®)や湿布薬(モーラス®テープ)、降圧薬(アジルバ®)などで選定療養の導入前と比べて後発品の使用割合が上昇したことが報告されています*3,4。
後発医薬品のある先発医薬品(長期収載品)の選定療養について|厚生労働省
プレスリリース「選定療養導入により後発医薬品への切替が急増 高血圧治療薬の切替患者は前年同月比155%の100万人超え|株式会社インテージリアルワールド(*3)
プレスリリース「選定療養導入により多くの製品で後発品比率が急増 一方、後発医薬品の在庫不足により先発品調剤が増える製品も」|株式会社インテージリアルワールド(*4)
後発医薬品を処方する際の注意点
ここまで後発医薬品の良い面を取り上げてきましたが、後発医薬品には注意すべき点もいくつかあります。
慎重な切り替えが推奨される薬剤
後発医薬品は先発品と有効成分は同じですが、それ以外の成分まで完全に同じわけではありません。このため、とくに抗てんかん薬や免疫抑制薬については、慎重な切り替えが求められています。
日本神経学会は『てんかん診療ガイドライン 2018』の中で、発作が抑制されている症例では服用中の薬剤を切り替えないよう推奨しています(CQ3-9)*5。日本移植学会は臓器移植後に免疫抑制薬として使用されるタクロリムスやシクロスポリンについて、移植臓器の機能が安定している症例で服用中の薬剤を切り替えないよう推奨しています*6。
筆者が専門とする皮膚科領域でも、たとえば抗真菌薬のイトラコナゾールは先発品と後発品の違いが指摘されている薬剤です。日本皮膚科学会の『皮膚真菌症診療ガイドライン2019』には、「生物学的利用率が先発品と必ずしも同等といえない製品があるとの報告」や「先発品から後発品に変更したところ症状が悪化し、先発品に戻したところ症状が改善した症例の報告」などから、「後発品投与時には注意が必要である」と記載されています*7。
日本神経学会 監修:てんかん診療ガイドライン2018.医学書院,2018(*5)
免疫抑制薬の先発医薬品から後発医薬品への切り替えに関して|日本移植学会(*6)
日本皮膚科学会皮膚真菌症診療ガイドライン改訂委員会:日本皮膚科学会皮膚真菌症診療ガイドライン 2019.日本皮膚科学会雑誌:129(13),2639-2673,2019(*7)
外観や味・基剤の違い
後発医薬品は、先発品と色や形、味や飲み心地などが必ずしも同一ではありません。とくに高齢者や視覚障害のある患者さんには、薬剤の変更で混乱を招いてしまうおそれもあります。
また外用薬の場合、有効成分だけでなく「基剤」も薬効に重要な影響を及ぼします。後発医薬品の基剤は、先発品と必ずしも同一ではありません。ヘパリン類似物質や副腎皮質ステロイド外用薬など、先発品との間に効果の差があるという報告もあります*8,9。
大谷道輝 ほか:基剤中に溶解している主薬濃度および皮膚透過性を指標としたステロイド外用薬の先発および後発医薬品の同等性評価.日本皮膚科学会雑誌 121(11):2257-2264,2011(*8)
野澤茜 ほか:ヘパリン類似物質含有製剤の先発医薬品と後発医薬品の評価.日本皮膚科学会雑誌 122(2):371-373,2012(*9)
適応疾患・保険適用の違い
先発医薬品と後発医薬品では、適応疾患や保険適用の対象が異なる場合があります。
たとえばバソプレシン受容体拮抗薬であるトルバプタンは、先発品のサムスカ®が「常染色体優性多発性嚢胞腎(ADPKD)の進行抑制」に対して効能・効果が認められているのに対し、後発品は心不全や肝硬変における体液貯留のみ、適用が認められています(2025年5月末現在)。
後発医薬品を巡る課題
後発医薬品を巡っては近年、「品質管理」と「供給不足」が注目されています。
2020年12月、小林化工が製造販売する抗真菌薬に、睡眠導入剤が混入する事件が発生しました(健康被害245名、死亡2名)。これを機に医薬品メーカーに対する一斉調査が実施され、複数の企業で製造管理や品質管理に問題が発覚しました。
もともと、過度な価格競争で製造リソースに余力がなかったこともあり、一部の後発医薬品で2022年ごろから、供給量の不足が生じていました。その後状況は改善しているものの、2025年現在も限定出荷や供給停止となっている医薬品が存在します。
この問題をふまえ、厚生労働省は2013年に策定した『後発医薬品のさらなる使用促進のためのロードマップ』を2024年に改訂し、『安定供給の確保を基本として、後発医薬品を適切に使用していくためのロードマップ』という名称に変更しています。
先述した「選定療養」の導入によっても後発医薬品への移行が加速し、限定出荷などの対応が取られたケースもありました。後発医薬品の普及を進めていく上で、品質の管理や供給の安定化は重要な課題と言えます。
後発医薬品に係る新目標について|厚生労働省 第176回社会保障審議会医療保険部会(2024年3月)
└p.2~ 製造販売業者の対応状況―医薬品全体(令和6年1月)
令和3年度 全国薬務関係主管課長会議 資料(2022年3月)|厚生労働省 医療用医薬品の安定確保策に関する関係者会議(第6回)資料(2022年3月)|厚生労働省 「安定供給の確保を基本として、後発医薬品を適切に使用していくためのロードマップ」及び「バイオ後続品の使用促進のための取組方針」の策定について|厚生労働省後発医薬品の出荷停止等を踏まえた診療報酬上の臨時的な取扱いについて|厚生労働省 関東信越厚生局
まとめ

今回は後発医薬品について見てきました。先発品よりも薬価が安く医療経済上のメリットがあることから、国が普及を推進してきた経緯があります。一方で、急速に普及した結果、品質管理や供給体制が不十分なケースも明らかになってきました。
高齢化に伴って医療費の増大は続いており、後発医薬品の普及を推進する方針は今後も変わらないでしょう。医師が処方せんを交付する際、後発医薬品への変更可否を記載する欄があります。医療経済を考えれば、後発医薬品への変更をできるだけ進めていくべきですが、先発品から後発品への切り替えには注意が必要な場合もあるため、個別具体的な対応が求められます。
この記事が後発医薬品に対する理解を深める一助となれば幸いです。